摘 要:细胞自噬是真核生物的一种高度保守的由溶酶体介导的降解过程.自噬将胞内物质包裹在双层膜的自噬小体内,运送到溶酶体进行降解再利用以维持细胞的稳态平衡.经过半个多世纪的研究,特别是研究自噬的遗传模型的建立,人们对自噬的分子机制和调控机理已经有了较为深入的了解.目前已经发现了20多个自噬相关基因(ATG 基因和EPG 基因)参与自噬小体的形成和成熟过程.多种信号通路,如氨基酸缺失、激素刺激等都参与自噬活性的调控.自噬参与生命过程的多个方面,自噬异常与多种人类疾病的发生发展密切相关,如神经退行性疾病、糖尿病、肿瘤等.多细胞生物自噬的分子机制和调控机理的研究对预防和治疗相关疾病有重要意义,并为研发药物提供理论依据和新的靶点.
关键词:细胞自噬;选择性自噬;蛋白质降解;神经退行性疾病;线虫
1 自噬的研究历史
自噬的发现最早可以追溯到19世纪50年代,比利时科学家汀·德·迪夫(ChristiandeDuve)通过电子显微镜观察到肝脏细胞内存在一类单层膜或者双层膜的结构,这些结构内常常包含有部分细胞质成分以及各种细胞器[1].随后托马斯·阿什福德(ThomasAshford)和基斯·波特(KeithPorter)注意到在胰高血糖激素(glucagon)的刺激下,在小鼠肝细胞(hepatocytes)中发现溶酶体包裹着处于不同降解阶段的线粒体[2].这是人们首次发现溶酶体除了降解内吞物外还可以降解胞内物质.1963年,迪夫在溶酶体国际会议上提出了自噬(autophagy)的概念,即“自己吃自己”[3].其后科学家称这种双层膜结构为自噬小体(autophagosome),其膜结构可能来源于内质网(endoplasmicreticulum,简称 ER)等细胞器,这一过程是溶酶体依赖的非选择性降解细胞内物质的过程[4]
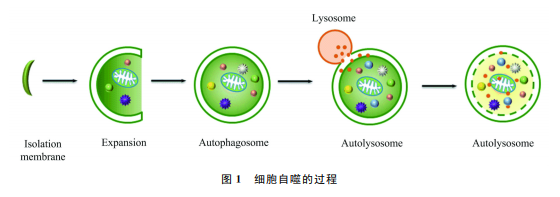
.20世纪60年代到90年代初,对自噬的研究主要是借助电镜在细胞系和各种组织切片中开展形态学上的观察.这一时期的研究发现了自噬小体的初始结构隔离膜(isolationmembrane),以及自噬小体与内吞体(endosome)融合的中间结构amphisome[5-6].经过近30年的研究,自噬过程逐渐明朗,如图1所示.自噬过程可以被分为一系列的步骤,包括诱导、隔离膜成核、扩展和闭合、自噬小体与内吞体及溶酶体融合、自噬溶酶体降解以及最后的大分子物质的循环再利用.然而,对自噬的早期研究并没有真正揭示自噬过程的分子机制,科研人员利用大量生化手段虽然寻找到了多个自噬活性的调控因子,但一直没有鉴定出参与自噬过程的关键因子.
2 酵母模型的建立
自噬过程发现后的30年中,因缺乏合理的研究体 系,人们对自噬分子机制的了解几乎停 滞.1992年,日本科学家大隅良典(YoshinoriOhsumi)实验室[7]在单细胞酿酒酵母中观察到自噬的现象.酵母内有一个巨大液泡,类似于动物细胞中的溶酶体.大隅良典通过光学显微镜观察到在蛋白酶缺陷酵母中,在氮源缺失的情况下,液泡内会积累大量的自噬小泡结构(autophagicbodies).这些小泡是在胞质中形成的双层膜自噬小体与液泡融合后释放在液泡里的自噬小体内膜及包裹物.在正常酵母中,液泡里的蛋白酶能非常快地降解这一结构,所以观察不到自噬小泡这一中间结构.大隅良典的这一发现建立了酵母为研究细胞自噬的遗传筛选模型.他们推测如果参与自噬小体形成的自噬基因缺失,自噬过程将会被阻止,饥饿诱导形成的自噬小体就可能被抑制,因此液泡中便不会有自噬小泡的累积.于是,他们饥饿(氮源缺失)处理蛋白酶缺失的酵母,诱导自噬发生,筛选那些在液泡中不累积自噬小泡的突变体.通过遗传筛选,他们得到了第一个酵母自噬基因,命名为apg1(之后被命名为 ATG1)[8].ATG1突变体在饥饿条件下存活率显著降低,表明自噬对酵母存活是必需的.随后他们首先筛选那些饥饿处理后存活率降低的突变体,然后再鉴定液泡内无自噬小泡聚集的突变体.通过筛选他们鉴定出了包括 ATG1在内的15个ATG 相关的基因[8].
在同一时期,美国科学家丹尼尔(DanielKlionsky)教授研究发现酵母液泡蛋白酶 Ape1的前体蛋白(proAPI)由胞质转运到液泡的通路(cytoplasmtovacuoletargeting,简称 Cvt)并不需要参与经典的分泌途径的基因,他们通过遗传筛选鉴定了一系列 Ape1前体运输缺陷的突变体,命名为 Cvt突变体[9].随后,大隅良典教授发现酵母的 Cvt通路与自噬过程基本一样,Ape1的前体是通过一种类似自噬过程的双层膜的转运膜泡(cytoplasmtovacuoletargetingvesicle,简 称 Cvtvesicle)包裹由胞质转运到液泡内[10].不同之处是 Cvt小泡比自噬小体要小,进一步研究揭示这些CVT 基因与大隅良典实验室发现的自噬基因部分 相 同.2003 年人们将参与自噬通路的 基因统一命名为 ATG 基 因 (autophagy-relatedgenes)[11].以往人们一直认为自噬是随机的包裹一些胞内物质进行降解,Cvt通路中水解酶前体运输过程提示自噬也可选择性地运送底物.后来发现自噬可以选择性地包裹一些受损伤的细胞器或蛋白聚集体进行降解.
通过上述两个相互独立的酵母遗传筛选共发现了大约20个自噬相关基因,介导自噬小体形成的不同步骤,它们作用于自噬小体的起始、延伸、闭合,以及与液泡融合等不同阶段,构成了自噬通路的核心组分[5-6].Atg1-Atg13-Atg17复合体参与自噬小体形成的早期阶段;磷脂酰肌醇3-激酶复合体(PI3K)结合调控自噬小体的形成;跨膜蛋白 Atg9穿梭于自噬起始位点和自噬小体间为自噬小体的形成提供膜来源;Atg12-Atg5和 Atg8-PE 两个类泛素的结合系统在自噬小体膜的延伸过程中发挥着关键作用.Atg8和 Atg12是两个类泛素蛋白,能够被类泛素化的分子共轭系统分别与磷脂酰乙醇胺(phosphati-dylethanolamine,简称 PE)和 Atg5蛋白连接.Atg8的前体分子被半胱氨酸蛋白酶 Atg4剪切后,被类泛素激活酶(ubiquitin-activatingenzyme,简称 E1)Atg7激活,随后被转移到类泛素转移酶(ubiquitin-conjugationprotein,简称 E2)Atg3上,并最终被连接到 PE上.Atg8-PE在自噬小体的外膜和内膜上都有定位,因此 Atg8-PE被广泛用作自噬小体的标记分子.在 Atg12系统中,Atg12在类 E1激活酶 Atg7和 E2转移酶 Atg10的作用下,与 Atg5共价连接.Atg12-Atg5偶联后与 Atg16相互作用,在 Atg16的聚合作用下,形成双倍的 Atg12-Atg5-Atg16复合体.该复合体在 Atg8与 PE的共轭连接中表现出泛素连接酶 E3的活性.至此细胞自噬的核心机制逐步展现出来,鉴于大隅良典先生在细胞自噬分子机制方面做出的杰出贡献,2016年被授予诺贝尔生理学或医学奖.
3 多细胞生物的自噬过程
随着人们在多种生物体,如拟南芥、果蝇、线虫、小鼠及哺乳动物细胞系中对自噬的广泛研究,发现自噬过程具有保守性.多细胞生物的自噬小体的形成与单细胞酵母的自噬过程相似,都起始于隔离膜的诱导、延伸、闭合,然后自噬小体与溶酶体融合降解底物,最后大分子物质循环利用.酵母中的研究工作极大地推动了高等动物细胞中自噬作用的研究进程.尽管如此,哺乳动物细胞中的自噬作用比酵母中的自噬作用要复杂得多.首先,在酵母中,所有的自噬小体起始于液泡附近的单一位点.这一位点被称为前自噬小体结构(pre-autophagosomalstructure,简称 PAS).而在哺乳动物细胞中,隔离膜可以在胞质内的多个位点同时发生[12-13].研究发现哺乳动物细胞中,自噬小体起源于内质网上 PI3P富集的区域,并形成形似希腊字母 Ω 的膜结构,称为欧米茄小体(omegasome)[14].欧米茄小体可以为 Atg蛋白的招募、膜结构的扩张以及自噬小体的形成提供平台.然后,隔离膜结构不断延伸,包裹着需要被降解的胞内物质,最终闭合形成一个双层膜结构的自噬小体.多细胞生物与酵母的自噬过程另一个明显区别是:在酵母细胞中,自噬小体直接与液泡融合降解底物;在高等生物细胞中,自噬小体在与溶酶体融合前,还需要经历一系列的成熟酸化过程.新产生的自噬小体会与一些内吞途径中的成分融合,例 如 早 期 内 吞 体(endo-somes)和多泡小体(multivesicularbodies,简称 MVBs)等,从而产生一个混合的结构.这种混合结构被称为中间囊泡(amphisome),较自噬小体更偏酸性.中间囊泡再与溶酶体融合,从而产生具有降解能力的自噬溶酶体[15].
多细胞生物不仅自噬过程高度保守,自噬的分子机制在进化上也高度保守.自1997年发现第一个自噬基因ATG1以来,共发现了大约18个保守的 ATG 基因构成了细胞自噬的核心分子机制,对自噬小体的形成是必需的(表1).这些基因在拟南芥、果蝇、线虫、小鼠及人中高度保守.多细胞生物自噬过程比酵母中的更复杂,且拥有不同细胞类型,除了拥有高度保守的 Atg蛋白外,应该有更多的因子参与或者有更为复杂的分子间互作.其中一种表现方式是同一个酵母 Atg蛋白在多细胞生物中会进化出多个同源物,这些同源物也会表现出功能上的冗余和分化.例如线虫中有两个 ATG8的同源基因,lgg-1 和lgg-2,在不同的发育时期不同的自噬阶段发挥不同的功能[16];在哺乳动物细胞中至少存在着6个酵母ATG8蛋白的同源物,它们都属于 LC3 和 GABARAP/GATE-16家族蛋白[17].
由于多细胞生物的自噬过程比单细胞酵母复杂得多,人们有理由相信,多细胞生物自噬小体的形成与成熟过程中,以及不同的组织细胞中,还存在着众多未知的重要参与基因.尽管已有广泛的生物化学分析方法被应用于发现参与多细胞生物自噬作用的因子,但是这些生化方法鉴定出来的大多是一些自噬活性的调控因子,而非参与自噬过程所必需的新基因.科学家急需寻找到一个适用于遗传筛选的多细胞生物模型来开展自噬新基因的筛选.
4 线虫自噬模型的建立
自1965年SydneyBrenner开始利用线虫进行发育生物学的研究以来,秀丽线虫凭借自身的许多特点,在众多生物学领域得到广泛应用.秀丽线虫作为一个仅有959个体细胞的生物体,它的成虫体长仅1mm,身体为半透明,以大肠杆菌为食物,它的生殖周期短(仅3d),后代数量多(约300个),易于在实验室条件下培养.此外,线虫还便于进行多种遗传操作.线虫有2个性别分为雌雄同体和雄性.雌雄同体既能够进行自体受精,也可以利用外源精子繁殖后代.这一特点为研究者对秀丽线虫进行经典遗传学分析提供了极大的便利.目前,科研工作者利用线虫在多个领域取得了重大突破,如细胞凋亡的分子机制、RNA 干扰(RNAinterference,简称 RNAi)现象的揭示、微 RNA(microRNA,简称 miRNA)的发现、衰老等.
线虫胚胎早期发育过程中,一系列不对称分裂将生殖细胞与体细胞分离.比如受精卵第一次分裂成2个细胞 AB及P1,AB只分裂形成体细胞,而P1是生殖母细胞(germblastomere).P1进行不对称分裂形成体细胞EMS及P2生殖母细胞.随后P2分裂成P3、P4生殖母细胞.P4进行对称分裂给出Z2、Z3两个生殖前体细胞.Z2及 Z3在胚胎期不再分裂,孵化后分裂形成上千个生殖细胞.20世纪80年代,科学家观察到存在于卵细胞中叫作P颗粒的蛋白/RNA 聚合体,在胚胎分裂中只在生殖细胞中,如P1到P4生殖母细胞和Z2、Z3生殖前体细胞中,而在体细胞中不存在.幼虫期 P颗粒在生殖细胞中合成,但不存在于精子中.胚胎发育中 P颗粒的这种不对称分布机制困扰了发育生物学家多年.张宏实验室利用标记了绿色荧光蛋白的 P 颗粒组成性成分之一的 PGL-1报告蛋白筛选到 P颗粒在体细胞中异常存在的突变体,惊奇地发现自噬基因的突变会引起 P颗粒的一些成分包括 PGL-1和 PGL-3在体细胞中累积,这些聚集体命名为 PGL颗粒(图2)[18].野生型线虫胚胎细胞中 PGL-1和 PGL-3仅在生殖细胞中分布,而在自噬基因lgg-1突变体的胚胎细胞的体细胞中PGL颗粒大量累积[18].进一步分析表明P颗粒随着卵母细胞的分裂也被分配到体细胞中,但位于体细胞中的 P颗粒成分 PGL-1和 PGL-3会被自噬通路降解.这一突破性结果不仅阐明了 P颗粒在生殖细胞中特异分布的一种机制,而且揭示自噬可以选择性降解发育过程中的蛋白聚集体[18].
5 线虫自噬的研究及自噬的生理意义
5.1 选择性自噬
利用自噬降解 PGL颗粒的现象,张宏实验室创立了可用于遗传筛选的多细胞生物自噬研究模型.通过 大 规 模 筛 选,得到了多个多细胞生物特有的自噬基因,分 别 命 名 为epg-1-11(ectopicPGLgranules,简称epg)[19-25].这是继20世纪90年代酵母遗传筛选寻找自噬基因后首次发现的新的自噬基因,这些新基因的鉴定极大地丰富了人们对多细胞生物自噬过程的理解.自噬降解 P颗粒成分证明了自 噬可以选择性地降解底物,但自噬如何选择性包裹底物的机制仍不清楚.研究人员进一步深入研究筛选到的自噬新基因,发现了多个epg 基因在选择性识别和降解蛋白聚集体中发挥重要功能.先前研究表明一类受体蛋白可以同时结合底物以及位于自噬小体内膜的 Atg8从而介导底物的识别[26].进一步研究发现在选择性自噬中还需要一类受体支架蛋白.比如 EPG-7作为受体支架蛋白,特异性地介导了包括SQST-1(线虫中自噬底物p62的同源蛋白)在内的多种蛋白聚集体的降解.EPG-7可以同时结合降解的底物和多种介导自噬小体形成的 ATG 蛋白,从而促进包裹底物的自噬小体的形成.支架受体蛋白EPG-7不仅赋予了底物降解的特异性,同时也将底物与自噬机器连接起来,提高了降解的效率[24].此外,工作人员还发现翻译后修饰在蛋白聚集体的降解过程中发挥着重要的作用.比如线虫精氨酸甲基转移酶PRMT-1的同源基因epg-11功能缺失,导致体细胞中 PGL颗粒降解缺陷[25].PGL颗粒降解需要与支架蛋白 EPG-2直接结合.EPG-11可以对 PGL-1和 PGL-3的 RGG 结 构 域 的 精 氨 酸 进 行 甲 基 化 修 饰,epg-11基因活性的 缺 失 减 弱 了 PGL 颗 粒 与 EPG-2 的 相 互 作 用,进 而 减 弱 了 PGL 颗 粒 与 LGG-1/ATG8的结合,从而降低了PGL颗粒的降解效率[25].这些研究揭示了选择性自噬的分子机制,并对阐明多种疾病中蛋白聚集体异常累积的机制有重要意义.
5.2 自噬小体形成与成熟
多细胞生物自噬小体的形成与成熟过程与内膜系统紧密联系.从自噬诱导之初的隔离膜形成到自噬小体延伸的膜来源,以及自噬小体闭合后与一系列内吞体和溶酶体的膜融合过程都与内膜系统息息相关.内膜系统尤其是内质网如何参与到自噬过程的各个阶段仍不清楚.电镜下观察发现隔离膜与内质网间存在着广泛的相互作用,但是这种相互作用的形成、维持以及解离的分子机制尚不清楚.
相关知识推荐:高被引论文怎么检索
研究发现线虫中鉴定的多细胞生物特有自噬因子 EPG-3(哺乳动物中同源蛋白为 VMP1)定位于内质网,参与调控隔离膜与内质网的相互作用[27].VMP1缺失会导致隔离膜与内质网的稳定结合,从而阻断自噬小体的正常形成.除了调控隔离膜与内质网互作外,VMP1还可以广泛调节内质网与其他细胞器,如脂滴、线粒体和胞内吞体的相互作用[27].另外广泛介导内质网与其他细胞器互作的 ER 蛋白 VA-PA/B也参与隔离膜与内质网的互作[28].自噬被诱导后,VAPA/B通过与在自噬早期发挥功能的 Atg1/ULK1蛋白复合体的成分 FIP200结合被招募到内质网上的自噬起始欧米茄小体.VAPA/B 能够维持FIP200/ULK1复合体的稳定性,也与 WIPI2蛋白互作,促进 ER-IM 的相互作用.这些工作揭示了 ER膜蛋白 VMP1和 VAPA/B调节自噬小体与 ER互作的机制(图3).
高等生物细胞自噬通路中,自噬小体的成熟过程包括与晚期内吞体的融合.线虫中鉴定的自噬基因EPG5参与调控自噬小体与晚期内吞体/溶酶体之间的特异融合[29].EPG5可以与 Rab7及晚期内吞体/溶酶体 上 的 R-SNARE 蛋 白 VAMP7/8 直 接 作 用,同 时 也 可 以 与 预 组 装 的 Qabc-SNARE 复 合 物STX17-SNAP29结合.EPG5通过结合自噬蛋白 LC3/LGG-1(人类和线虫中 Atg8的同源蛋白)来识别自噬小体,并促使SNARE复合物 STX17-SNAP29-VAMP7/8的组装,从而促进自噬小体与晚期内吞体/溶酶体的融合(图4).EPG5缺失引起自噬小体与多种膜泡结构的错误融合,从而形成降解功能缺陷的自噬溶酶体.
5.3 自噬与神经退行性疾病
细胞自噬的功能主要有两个方面:一是在胁迫环境下,自噬可以将一部分胞质降解成氨基酸等,为细胞存活提供能量和物质,这是细胞的一种自我存活机制;另外一方面,自噬可以清除变性或错误折叠的蛋白质、衰老或损伤的细胞器等,进而维持细胞的内稳态.迄今为止,人们对自噬过程的生理功能的了解还很有限.有研究发现,自噬异常与神经退行性疾病的发生密切相关[30].神经退行性疾病主要是由神经元丧失所导致的运动失调、学习认识障碍等.由于神经元是不可再生的,无法通过细胞分裂去除受损的细胞,所以通过自噬途径及时清除胞内有害物质就显得十分重要.在许多神经退行性疾病的受损神经元中发现了自噬小 体/自噬溶酶体聚集,如阿尔茨海默症(Alzheimer’sdisease,简 称 AD)、帕 金 森 病(Parkinson’sdisease,简称 PD)、亨廷顿舞蹈病(Huntingtondisease,简称 HD)、肌萎缩性脊髓侧索硬化症(amyotrophiclateralsclerosis,简称 ALS)等病中都发现了自噬溶酶体聚集,但这些自噬溶酶体的降解功能是缺损的.对自噬的研究将对这些疾病的诊断和治疗提供有利的帮助,参与调控自噬过程的蛋白将可能作为重要的药物靶点.
科学家构建了自噬基因敲除小鼠来研究自噬在神经细胞中的功能.参与自噬小体形成早期的基因Atg5和Atg7敲除小鼠呈现出广泛神经退行性病变,大量神经细胞无选择性地死亡,但未表现出人类神经退 行 性 疾 病 的 选 择 性 神 经 元 丢 失 这 一 特 征[31-32].近 年 来,张宏实验室构建了 Epg5 及 Wdr45/Wipi4(epg-6在哺乳动物中的同源基因)缺失的小鼠来研究自噬与神经退行性疾病的关系.Epg5敲除小鼠呈现出进行性神经功能缺陷的表型,随着小鼠年龄的增加,双后肢肌肉萎缩无力,到后期发展成双后肢完全瘫痪[33].Epg5敲除小鼠大脑皮层第五层的和脊髓前角的大椎体细胞选择性地缺失.Epg5基因敲除小鼠由于自噬异常,自噬底物p62在大脑和脊髓中的神经元和神经胶质细胞内异常聚集.中枢神经系统中累积了大量异常的自噬体结构.Epg5基因敲除小鼠表现出选择性运动神经元丢失,进行性肌无力和肌肉萎缩,呈现出肌萎缩性脊髓侧索硬化症(ALS)的主要特征.人类遗传学研究发现人类 EPG5基因的隐性突变会引起一种叫 Vicisyndrome的多系统紊乱综合症[34],Epg5基因敲除小鼠表现出了Vici综合症症状的一些表型,Epg5在自噬通路中分子机制的研究对阐明 Vici综合症的发病过程有重要作用.——论文作者:张 宏,张 慧
转载请注明来自:http://www.lunwencheng.com/lunwen/nye/21980.html