摘要: 植物表型组学研究正逐渐向综合化、规模化、多尺度和高通量的方向快速发展。本文首先介绍了植物表型研究的最新动向。然后针对室内表型监测平台的特点和各类室内表型针对的表型性状进行了系统介绍,包括产量、品质、胁迫抗性(包括干旱、抗冷热、盐胁迫、重金属和病虫害)等。在此基础上,本文还根据通量、传感器集成度和平台大小等把一些国内外流行的室内植物表型平台进行了分类,并介绍了这些室内表型平台在植物研究中的应用情况。同时,本文还介绍了室内表型数据的管理和解析方法。最后,本文着重讨论了室内表型平台的发展方向,并结合中国植物研究的实际情况对表型组学在中国的发展提出了展望,以期为中国植物表型研究提供指导和建议。
关键词: 植物表型组学;室内表型监测;产量性状;品质性状;抗性表型;表型数据管理和解析分类
1 植物表型组研究发展现状
近年来随着跨学科植物研究的深入,植物表型组学的重要性和迫切性已获得了学术界的普遍认可,例如作物育种可以通过高通量表型采集和分析技术推动基因分型和基因组研究[1,2],植物种质资源的构建需要依靠表型组学扩展新群体,快速寻找重要性状和总结作物改良途径[3-5],表型分型技术可以促进基因资源库和遗传多样性的有效管理[1,6,7],大幅提高作物栽培效率,相关理论积累也需要通过对重要农艺性状的自动化提取和快速分析完成[8,9]。此外,田间表型大数据的高速获取和有效管理还有助于农业生产的精准化和可持续发展等[10,11]。因此,植物表型组学不但可以为基础研究服务,还可为作物育种、栽培和农业生产等应用研究提供理论基础和技术手段。植物表型的监测和分析手段也逐渐向综合化、规模化、多尺度和高通量的方向发展[12,13];表型信息的获取从原来的单一时间点、人工观测为主的方式,正朝全生命周期、多尺度和自动化的方向改进[5,14]。
目前,欧美主要发达国家的政府和研究机构都在针对植物表型研究积极布局,对该领域投入了大量的时间和经费来建设可共享的室内外植物表型平台,而且还出台了多项国家级的研究计划,例如由欧盟研究理事会资助的欧洲植物表型联盟(European Plant Phenotyping Network, EPPN 2020;www.plant-phenotyping-network.eu)和旨在共享欧洲各国表型设施的EMPHASIS计划(emphasis.plant-phenotyping.eu),已持续超过10年的澳大利亚植物表型研究平台计划(Australian Plant Phenomics Facility;www.plantphenomics.org. au),英国最新设立的国家植物表型组计划(PhenomUK,www.phenomuk.net),由美国国家科学基金会和能源部共同资助的TERRA-REF平台计划(terraref.org/data/sensing-components),由瓦赫宁根大学和乌得勒支大学共同承建的荷兰植物生态表型研究中心(Netherlands Plant Eco-phenotyping Centre;www.wur.nl/en/product/The Netherlands-Plant-Eco-phenotyping-Centre-NPEC.htm),以及由民间发起、德国尤利希研究所牵头的国际植物表型联盟(International Plant Phenotyping Network,IPPN;www.plant-phenotyping.org)
[16-19]。上述国家级大型科研项目一般以建设多尺度表型数据采集和分析平台为主,通过室内外表型获取技术采集各个层面(如细胞、组织、器官、植株和群体等)的植物表型组数据,再使用各类传统或智能化数据解析方法从海量数据中提取可信度高、高可重复性的重要性状信息[11,13],进而为解决基因挖掘、作物育种栽培以及农业生产等中的实际问题提供大数据支持和方法学支撑[20-23]。
中国植物界对表型组学的研究热情也呈持续上升的趋势。根据不同的应用场景和研究方向,中国植物表型组学研究在植物监测技术[24]、作物育种[25]、种质资源鉴定[26]、农业生产[27]、田间作物表型信息获取和解析[28-31]、作物精确栽培应用[32-34]、平台建设和技术应用[35]、农业大数据管理和挖掘[36]研究领域的进展[37,38]及表型研究现状和展望[22,39]等多个方面取得了显著的进展。
2 室内表型监测平台应用场景和主要特点
表型数据采集和分析手段是植物表型组学研究的核心部分,包括了室内和室外两部分。根据平台和设备的不同,室内外采集技术大致可分为人载(包括手持)、车载、定点监控、大型自动化平台和室外航空机载及卫星成像等;其数据采集和管理具有数据量大、附加信息多(如地理位置、光温水气等环境因素)、获取标准不统一、数据不确定性高、重复性低和时效性高等多个特点[39-41]。如何通过大数据分析对采集的植物表型组数据进行预处理、在整合多源数据和数据挖掘技术的基础上把海量数据转化为可用的性状信息是现在表型组学所面临的最大挑战。由于室内表型监测技术可以对各类环境因素进行精确调控(如在人工气候室对空气温湿度、光照长度和光谱区间、以及相应的水、热、光周期等进行调节),同时还可以严格控制生长箱或温室中的植物的生长条件(如对土壤中水分和养分的监控、种子原生态环境条件的控制等),因此室内表型监测技术能够在复杂实验条件下对作物生长发育进行精确分级模拟和针对性研究[8,18]。基于室内表型平台精确调控、分级模拟和自动化精准采集等特点,室内表型检测有着室外表型技术难以复制的优势,因此其在植物研究中有着重要的意义。本文将着重对室内表型检测平台技术及相应的性状鉴选问题展开讨论,即在不同室内研究条件下,根据不同的植物研究目标,通过室内表型获取和后期数据解析完成对植物关键性状的鉴定。
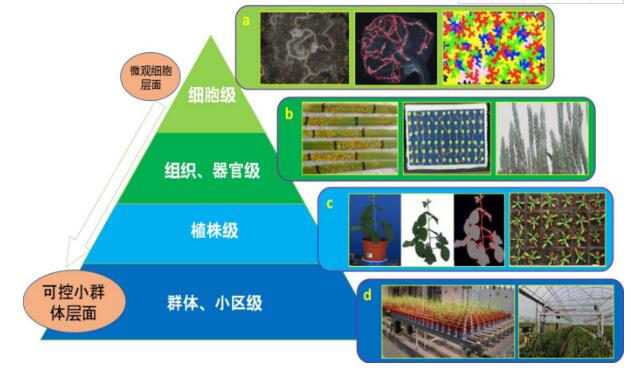
现代化室内高通量植物表型检测平台一般通过自动化传送设备和集成化传感器(如可见光、近红外、远红外、荧光、多光谱、激光、高光谱等)完成对与植物遗传与变异等密切相关的植物动态生长发育表型数据集的获取。其优势为高分辨率、高可控性和高通量,可为后续的植物表型分析提供高质量的多维图像和实验数据[4,42,43]。无论是地上还是地下部分,室内表型监测在尺度上通常以单株为单位,通过归集单株特征描述群体特征。根据图像传感器精度,所提取的表型数据往往可以精确到组织细胞层面。因此,室内表型性状的尺度划分可上至群体,下至组织细胞。比如,在细胞层面上,如图1(a)所示,通过高速共聚焦显微镜(High-speed Confocal Microscopy)和高通量细胞筛选系统(High-content Screening System)可对大量细胞表型开展植物抗病遗传机制等方面的研究,包括胞吞作用(endocytosis)[44],胼胝质沉积(callose deposition)[45]和细胞结构变化的表型分析[46]。在组织和器官层面,如图1(b),多种自动或半自动的室内成像系统可获取各类锈病、发芽率和花期等图像光谱数据,以此开发计算机图像分析算法提取重要表型特征参数[47-50]。在植株层面,图1(c),自动化传送系统和多角度、多传感器的拍摄技术可对盆栽植株进行图像获取和近实时植株分割[51,52],以此完成对多植株的连续生长性状监测[49,53]。在大型室内环境中还可以对小群体进行表型数据采集和表型分型鉴选(图1(d)),如在温室中使用经济型激光雷达(LiDAR)对小群体进行三维重建,进而分析作物产量性状[54],以及通过集成多光谱和高清成像设备高通量采集室内种植的作物小区的关键农艺性状等[5,8]。值得指出的是,很多自动化室内表型平台和设备的研发皆由商业机构和大型科研机构推动,其中包括德国LemnaTec的高通量室内植物表型筛分系统(如LabScanalyzer和Scanalyzer HTS),捷克PSI的PlantScreen系统,比利时CropDesign的TraitMill系统(已被德国巴斯夫集团收购),华中农业大学和华中科技大学共同开发的水稻表型设施HRPF,以及中国科学院植物研究所和上海泽泉科技股份有限公司共同研发的PhenoWatch系统等。这些系统被广泛应用于室内植物的统一管理和可控条件下的植物形态特征的监测,应用于突变体筛选
[55],抗旱性分析[4],生长表型和产量的相关性分析[8],水稻全基因组关联研究和基因座定位[5]及作物高精度三维重建和表型结构参数的提取[54]等不同研究方向。
(a)细胞层面对胞吞作用[45],胼胝质沉积[46]和细胞结构变化的表型分析[12]; (b)组织和器官层面对各类锈病、发芽率和花期等性状分析[47-50];(c)单株层面对单株的图像获取、植株分割和生长监测[49,51-53]; (d)小群体和小区层面的表型数据采集和关键农艺性状分型鉴选[5,8,54]。
通过结合室内环控设备(如可控温室和人工气候室),室内表型采集技术还可以模拟多种野外生长条件,进而评估表型的可塑性和稳定性,全方位对关键表型性状(如产量、品质和各类抗性指标等)进行鉴定,获得具有统计学意义的研究结论[42,56,57]。由于这类研究很难在室外通过调控田间试验条件完成,因此室内表型监测在数量性状基因座(Quantitative Trait Locus,QTL)分析、全基因组关联分析(Genome-wide Association Study,GWAS)、基因表达鉴定等方面有显著的优势。室内表型监测是最早应用于品系筛选、关联表型和基因组信息及遗传结构解析等研究方向上的植物表型技术[20,58,59]。最近几年,通过综合表型组信息、主要环境因素和遗传基础,室内表型监测还逐渐被应用于建立各类产量、品质和抗性模型,以此预测不同作物与重要环境因素动态互作下的表现[8,13,60]。
推荐阅读:高级农业职称评审要求发几篇核心论文
3 室内表型监测平台所针对的表型性状
在过去的十年中,植物表型组学已逐渐从新兴研究课题发展成为高速发展的多学科交叉研究领域。表型作为基因型和多种环境间互作的结果(Genotype-environment Interaction,GxE),不仅可以通过细胞、组织、器官和植株的物理结构变化来衡量,还可以通过各类生理生化相关的表型参数来验证[7,61]。国内外各类室内植物表型平台一般基于上述思路进行设计研发。从比利时CropDesign公司的第一套大型植物高通量表型分析平台TraitMill问世至今[62],室内植物表型性状获取技术正向着多样化、自动化和高通量的方向发展。其获取的性状可分为地上(如生物量、株高、穗粒数和结实率等收获指数)和地下(如二维、三维的根系形态性状等)两部分[42]。根据不同的生物学问题,本节将着重介绍室内表型平台所针对的各类表型性状及其相对应的采集参数和生物学问题。
3.1 产量相关表型性状
产量的本质是生物量,作物产量与收获植物器官如禾谷类作物种子的生物量有极显著的相关性[63]。对产量评估一般包含三个重要指标:单位面积穗数,每穗粒数和籽粒的单位重量[64]。由于这些指标很难在田间试验中无损检测,因此与产量相关的表型被大量应用于各类作物产量检测和研究中[65]。在室内条件下可检测的与产量相关的表型性状分为地上和地下两部分:地下部分针对植物根部的根系尺寸(如根深、二维根宽和根长等)和根系的三维形态、结构特征等[66-68];地上部分针对一些重要器官的形态参数(如叶长、叶宽、冠层面积、植株高度和三维植株体积)和一系列重要农艺性状(如分蘖数、叶数及单位面积穗数等)[21,69,70]。最新研究还借助X射线断层扫描分析技术(X-ray Computed Tomographic Analysis)对麦穗和穗粒分别进行三维特征重建,以此完成不同处理条件下穗重、粒重和粒数与粒型和穗型的相关性分析[71]。产量相关性状与植物生长发育密切相关,因此各类生长特性曲线(即生物量和时间的相关性)也被用于产量评估,比如在室内表型研究中会使用生长速率结合生物量参数对作物产量做相关性分析[72],通过多角度摄像和多视图运动恢复结构技术(Structure from Motion with Multi-View Stereo,SfM-MVS)获取盆栽小麦的株高,叶数和分蘖数等特征,最后通过人工校验得出作物早期生物量和叶面积的增长率与最终产量的关系[60]。除了形态结构,产量也可通过与光合作用相关的表型参数来预测[73]。在不同光照强度下,通过表型性状可评价各项光能转化指标,以此在植株层面对生物量的换算进行建模。这一类分析方法还被应用于光能、营养、CO2释放速率、水分利用效率和单株产量的精确检测分析[74]。
收获后的产量表型至关重要,因此如何在收获后提取可靠的产量表型性状也获得了研究者们的重视。比如种子收获后通过phenoSeeder平台的机器臂和吸盘可对单个大麦或油菜等种子进行单个籽粒的三维形态分析和称重
[75]。因为对禾本科籽粒的长宽、数量和重量进行大规模自动化分析可准确反映产量,所以新型的玉米籽粒性状测定系统(Maize Kernel Traits Scorer,MKTS)通过线扫描成像、图像处理和自动控制技术自动测量玉米籽粒的12种性状,为玉米遗传和玉米育种研究提供可靠的产量相关参数[76]。微型计算机断层扫描技术(micro-CT或μCT)近来也被应用于产量分析,在对玉米籽粒之间的差异和玉米丰满度(如籽粒密度,孔洞,孔隙率等表型)进行分类评价后,综合这些参数可反映玉米产品的产量和质量,为鉴定玉米的品质和种质资源服务[77]。
3.2 品质相关的表型性状
室内条件下与作物品质相关的性状一般围绕植物收获器官的形态结构变化和生理生化指标等展开。以禾谷类作物为例,各类生理生化指标一般通过高光谱(如近红外)拍摄的光谱照片结合多光谱分析技术无损检测稻麦或玉米的营养成分如直链淀粉、葡聚糖等碳水化合物[78,79]。收获器官的油脂含量、蛋白质含量和水分等也可得到相对准确的测量[80];相同的方法也被应用于检测植物中的各类微量元素(如铁、锌、硼、磷等),以此评估作物品质[79,81]。此外,结合高光谱反射和荧光成像系统的摄像设备还被用于分析各种化学成分在植物组织中的空间分布情况(包括油脂、蛋白质、水分和碳水化合物等),为作物根据营养成分分级提供量化标准[82]。
值得指出的是,作物品质通常很难仅仅依靠形态结构特征来评价。因此,结合收获器官的各类营养含量和品质相关的形态特征(如收获器官的大小、生长速率和颜色变化等)亦可作为品质分级的依据[79,83]。比如,对各种园艺作物的形状、大小、色泽、种皮厚薄、纤维长度和强度等性状分析可以对产品的综合品质加以定义[84,85]。最后,近年来随着代谢组学的发展,越来越多的小分子化合物也能被检量,通过化合物组成可定位代谢相关的基因组,也为品质检测提供了新的途径[81,86,87]。
3.3 胁迫相关的抗性表型
生物和非生物胁迫(biotic and abiotic stresses)可导致产量和品质的下降,是植物表型研究的重要方向之一[21]。在室内条件下,对各类逆境模拟技术已日趋成熟,可针对不同作物设置不同逆境和胁迫实验,以此研究环境因素对植物生长发育的影响,为抗性鉴定和农业生产提供指导[10,88]。在全球气候变化加剧和人口压力渐增的今天,如何在恶劣天气条件下维持作物产量和品质变得愈发重要。因此高通量、大规模鉴选具有明显抗性特征的作物品种将加速作物遗传选择和选育栽培的研究进程[89,90]。植物抗性可分为避性、御性和耐性三种形式[14,91],根据植物与不同逆境的交互情况,又可分为抗旱、抗涝、抗冷(抗冻)、抗热、抗盐、抗污染、抗病等特性[92-94]。本节简要介绍了室内平台可测的抗旱、抗冷热、抗盐、抗污染(重金属)和抗病虫害等数种抗性特征。
3.3.1 干旱胁迫
中国因干旱造成的粮食损失一度达到每年数百亿元人民币[95,96],利用表型组学技术加速作物抗旱性状的研究有迫切的现实意义。在温室培养下,Chen等[4]使用基于可见光、荧光和近红外等多种光谱技术对18个大麦基因型的400多个性状进行了统计;然后通过多重共线性分析(Multicollinearity Analysis)等方法筛选出六个主成分性状簇,以此分析作物对干旱的敏感程度。前文提到的X射线断层扫描分析技术对麦穗和穗粒的三维分析[71],其实验设计也是为了研究不同干旱胁迫下穗重、粒重和粒数的变化。针对水稻抗旱育种,Guo等[97]基于图像提取了507个水稻品种的51个基于图像的性状(i-traits),并通过这些i-traits监测不同水稻品种的干旱反应、性状的遗传力和变异,进而通过全基因组关联研究确定了470个关联基因座。
基于根发育和根形态的表型组学研究对于研究作物抗旱机理同样作用显著。这类研究一般将根系浸置于琼脂中或半悬空拍摄,因为干旱胁迫能够阻止次生根的发育,可将悬空的根系一侧贴在湿滤纸或琼脂上可形成水势梯度,使次生根的分生组织向有水的一侧发育[98,99]。在根袋中培育幼苗获得幼根的构型也被用于抗旱性的筛选,通过总根长和侧根数的计量可分析抗旱与产量的关系[67]。生长素、脱落酸和细胞分裂素等植物激素对根形态发育起到重要作用,因此有的研究团队对干旱条件下根系中的特定激素也开展了一系列研究[100]。较为昂贵的核磁共振成像(Nuclear Magnetic Resonance Imaging,NMRI )技术也逐渐被用于对植物组织中水分的鉴定,借此完成对抗旱性的精确分级[101,102]。
3.3.2 抗冷或抗热胁迫
用红外线获取水稻冠层温度对高温胁迫的响应,可发现热胁迫下冠层温差大的品种有更好的耐热性(canopy temperature depression),这是因为蒸腾作用有冷却效果,通过这种方式获取的材料可作为潜在的耐热种质资源。此外,通过3D图像可以测得热胁迫下番茄的生物体积(biovolume,一种生物量的度量方式),从而检验和筛选耐热基因型[104]。和其他胁迫类型相比,与冷胁迫相关的表型组学研究主要集中于检测叶绿体荧光变化和光合作用的关系[105]。拟南芥在经过4℃低温驯化(acclimation)后投入到寒冷环境中(10、4、0和-1.5℃),驯化后的材料光合作用峰值提前,荧光量子产额(Quantum Yield of Fluorescence)中表征非光化学淬灭的比重增加,光合作用比重减少[106]。通过荧光图像获取的表型数据也可用于对部分水稻抗寒品种从低温环境回归理想环境后的光合作用进行表型分型[107]。
3.3.3 盐胁迫和重金属胁迫
干旱环境在植物生理上存在渗透压胁迫,这也是盐胁迫所产生的生理效应[108]。由于可耕种土地的日益减少和围海造陆策略的推广,盐碱地和滩涂地的利用使得作物抗盐的重要性与日俱增。生理方面,盐胁迫除了和干旱一样存在渗透压胁迫外,还有离子胁迫,而且后者对叶绿体影响较大。因此,可以用叶绿体荧光光谱特征来区分早期的渗透和离子胁迫,以此研究作物在盐胁迫下的生长发育情况[109]。此外,根据荧光波段由红向绿的规律还可通过谱带制作数码标记来指示离子胁迫水平,标注盐胁迫下的早期生长速率。当然,幼根在盐胁迫下也存在一定的避性,即幼根有向着盐浓度低的方向生长发育的表型特征[110]。
重金属胁迫与盐胁迫机理相似,在琼脂中建立不同重金属离子的浓度梯度可对胚根表型进行分析,胚根会根据浓度产生生长方向改变及增粗的表型特征[111]。重金属等有毒有害物质除了影响作物产量外还会影响作物的卫生品质,即污染物会从根部向上迁移影响到收获器官。当前污染物在作物体内追踪主要依靠X光技术[112],通过X射线荧光光谱仪可探测菜豆种子中的锌含量、桉树根中的铅含量,以此获取污染物原位分布图和含量评估[113]。依靠X射线吸收结构荧光还被用于获取水稻和小麦中砷在各器官中的含量,可判断砷是否在地上部分富集[114]。
3.3.4 病虫害胁迫
作物对病虫害的抗性不同于对非生物胁迫的抗性,存在着寄生或取食等种间关系。因此植物抗病虫害的等级一般以其被寄生或取食的表型来评判,如叶片受病虫害入侵的程度,病斑数量和大小、病斑颜色和病叶比例等[115,116]。病害等级能够通过红外光谱成像来获得叶片病斑面积,通过人工校验可以区分病斑和衰老造成的斑点[117,118]。通过深度学习可以对大量植物疫情照片训练,建立模型后对疫病的种类(如斑病、锈病)和程度进行准确鉴定[119]。热红外感光也有通过温度指示疫情的研究实例,例如花生接种叶斑病后经测算叶片温度较健康叶片高2~3℃[118]。和抗冷、抗热胁迫一样,植物病虫害表型主要是对胁迫的响应,包括功能受损和防御策略:如大麦抗粉病品种Irina的病斑可表征抗病反应[120];在病原体攻击时植物抗病基因产生的病斑数可表征抗病等级[121];害虫的侵入也可以通过连续监测害虫的行为来分析,如蓟马在拟南芥叶片上的停留时间被用于评估植物抗性的依据[122]。
与害虫的取食不同,病原菌更加微观,寄生于胞内或胞间。因此,植物的抗性还可通过更加微观的组织或细胞表型来反映。例如通过显微镜或高通量细胞筛选系统可获得胞间物质传递或胞内细节的荧光图像,再通过图像处理实现细胞尺度的抗病表型分析[123-125]。对病原体鞭毛诱导特异性受体抗病蛋白后产生的荧光拍摄,可以确定这种蛋白跨膜运输的激活机制[125];细胞自噬本身不像受体那样能识别病原体蛋白,其抗病作用可通过分解自身能量贮存物或分解病原体来实现,因此识别自噬结构也是抗性鉴定的重要环节[126];微管蛋白的形成是另一种非特异性的抗逆机制,同样可以依靠图像处理实现细胞表型的定量分析[46];在不依靠荧光的情况下,通过高通量拍摄气孔的闭合程度亦可分析植物抗旱和抗病机制[127]。
4 室内植物表型监测平台分类和数据解析方法
上文所述的各类表型性状需要多种技术手段采集和解析,因此多种室内表型获取平台得以开发。由于室内植物表型平台的分类在国际上没有统一标准,对于平台的划分一般根据通量、价格、传感器集成度、平台规模大小和占地面积等方面综合考量。本文在综合了室内植物表型平台的测量对象和规模后,将室内平台分为大中小3类进行介绍(图2)。
4.1 大型室内植物表型平台
根据应用场景的不同,大型室内表型组学研究设施通过采集和分析可控环境条件下植物的表型信息,来实现自助化、规模化的研究目标。这类平台的表型采集方式通常可分为传送式(plant-to-sensor)和轨道式(sensor-to-plant)[128,129]。国际上大多数的室内表型设施属于传送式设计,即植物在传送带上培养,通过电动马达传送至成像区域进行拍摄;轨道式表型系统主要根据温室结构搭建可移动的采集系统,可实现植物原位成像。大型室内平台一般都配备有自动灌溉装置,可实现自动补水等实验措施。另外,盆栽都会贴有二维码以保证对植物品种、实验方式和生长情况的跟踪。传送带式表型平台能够通过增加传送带数目扩大整个室内平台的容量,同时可以根据实验设计加装定制化光传感器,因此可满足多种实验需求。然而,此类表型平台需要专业人员的长期技术支持,平台价格和维护成本较高,很难大规模推广应用。轨道式表型平台操作流程相对简单,通过一定的培训就能够掌握平台使用,而且其架设所需场地较小,也可通过改进结构、增设新型传感设备扩大监测范围。此类平台相对价格适中,其主要问题是相对有限的有效载荷限制了可集成的传感器数量,另外数据采集质量和通量略逊于全自动传送带平台。需要指出的是,大型平台一般依赖于特定的商业软件管理数据来完成表型量化分析,因此软硬件的升级、特定功能的定制和更新迭代的代价很高,需要在购置安装前特别加以注意。表1列举了一些国际上比较常见的大型室内表型平台。——论文作者:徐凌翔 1, 陈佳玮 1, 丁国辉 1, 卢伟 2, 丁艳锋 1, 朱艳 3, 周济 1,4
转载请注明来自:http://www.lunwencheng.com/lunwen/nye/16915.html